~乙種第4類危険物取扱者試験~イオン・電離・酸・塩基・中和・酸化・還元~
「イオンと電離・酸、塩基及び中和・酸化と還元」について解説しています。
~イオンと電離~
きわめて純粋な水は、ほとんど電気を導かないといってよいが、これに少量の食塩(NaCl)を入れると電気を導くようになる。水の中で、ナトリウムと塩素が電気を帯びた原子になるからである。このように水溶液中で電気を帯びている原子又は原子団をイオンという。
イオンには陽イオンと陰イオンの2種類がある。またイオンの陰陽の電気量すなわち電荷は原子価に比例する。
水に溶けた食塩のように、電離する物質を電解質といい、多くの無機化合物(無機酸、無機塩基及び無機塩類)が該当する。これに対して電離せず電流も導かず、電解もしない物質を非電解質といい、多くの有機化合物が該当する。この違いは、原子が結合して分子を構成する場合の結合のしかたによる。
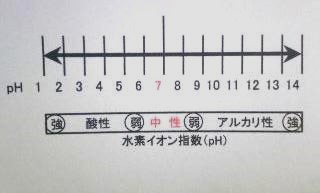
~酸、塩基及び中和~
「酸、塩基」
酸とは、水溶液のなかで電離して水素イオンH+を出すものをいう。
塩酸、硝酸、硫酸などのように、強く電離するものを強酸といい、さく酸や炭酸のように電離の弱いものを弱酸という。
塩基とは、水溶液の中で電離して水酸化物イオンOH-を出すものをいう。
「酸と塩基の比較」
(酸)
・酸味があり、青色リトマス試験紙を赤変する。(梅干し:青→赤)
・水溶液中で水素イオンを出す。
・塩基と中和して塩をつくる。
・一般に金属に作用して水素を発生する。
(塩基)
・水溶液は苦みがあり、赤色リトマス紙を青変する。
・水溶液中で水酸イオンを出す。
・酸と中和して塩をつくる。
いずれも人体に付着すると、皮膚等をおかす危険性がある。
「金属の性質」
①イオン化傾向
金属は、酸と反応するときに水溶液中で陽(+)イオンになりやすいが、そのなりやすさは金属によって差があり、陽イオンになりやすい金属は、化学的に活性であるという。
このイオンになりやすさの違いをイオン化傾向といい、金属元素をイオン化傾向の大きい順に並べたものを、イオン化傾向列(イオン化列ともいう)という。
主な金属をイオン化傾向の大きい順に並べると次のようになる。
なお、イオン化傾向列に、非金属の水素(H)を並べてあるのは、金属の水又は酸に対する性質を示すもので、水素イオン化傾向の大きいカリウム、ナトリウム等は、水の中で電子を失って、K+、Na+となり、H+は電子をもらって水素原子となり、さらに結合して水素分子(H2)となる。

②軽金属と重金属
金属類は他の物質と比較し、重いものが多いが、その金属をさらに軽金属と重金属に区分することもある。
一般に、比重4以下の比較的軽い金属を軽金属、比重4を越える金属を重金属という。なかには水より軽い金属(比重1未満の金属※)もある。
軽金属:カリウム※、ナトリウム※、マグネシウム、アルミニウムなど。
重金属:金、白金、銀、水銀、銅、鉄など。
~酸化と還元~
(1)酸化(酸価数が増える)
酸化とは物質が酸素と化合したり、水素化合物から水素を除去すること、又は、原子が電子を失うことをいう。
(2)還元
還元は酸化の逆で、酸化物から酸素を除去したり、物質に水素を化合させること、又は原子が電子を受けることをいう。
一般に酸化と還元は常に同時に起こるものである。なお、他の物質を酸化する力のあるものを酸化剤といい、他の物質を還元する力のあるものを還元剤という。
